Какая рнк отвечает за синтез белка. Синтез белков в клетке - описание, функции процесса
Почти полвека тому назад, в 1953 г., Д. Уотсон и Ф. Крик открыли принцип структурной (молекулярной) организации генного вещества - дезоксирибонуклеиновой кислоты (ДНК) . Структура ДНК дала ключ к механизму точного воспроизведения - редупликации - генного вещества . Так возникла новая наука - молекулярная биология. Была сформулирована так называемая центральная догма молекулярной биологии: ДНК - РНК - белок. Смысл ее состоит в том, что генетическая информация, записанная в ДНК, реализуется в виде белков, но не непосредственно, а через посредство родственного полимера - рибонуклеиновую кислоту (РНК), и этот путь от нуклеиновых кислот к белкам необратим. Таким образом, ДНК синтезируется на ДНК, обеспечивая собственную редупликацию, то есть воспроизведение исходного генетического материала в поколениях; РНК синтезируется на ДНК, в результате чего происходит переписывание, или транскрипция, генетической информации в форму многочисленных копий РНК; молекулы РНК служат матрицами для синтеза белков - генетическая информация транслируется в форму полипептидных цепей. В специальных случаях РНК может переписываться в форму ДНК ("обратная транскрипция"), а также копироваться в виде РНК (репликация), но белок никогда не может быть матрицей для нуклеиновых кислот (подробнее см. ).
Итак, именно ДНК определяет наследственность организмов, то есть воспроизводящийся в поколениях набор белков и связанных с ними признаков. Биосинтез белка является центральным процессом живой материи, а нуклеиновые кислоты обеспечивают его, с одной стороны, программой, определяющей весь набор и специфику синтезируемых белков, а с другой - механизмом точного воспроизведения этой программы в поколениях. Следовательно, происхождение жизни в ее современной клеточной форме сводится к возникновению механизма наследуемого биосинтеза белков.
БИОСИНТЕЗ БЕЛКОВ
Центральная догма молекулярной биологии постулирует лишь путь передачи генетической информации от нуклеиновых кислот к белкам и, следовательно, к свойствам и признакам живого организма. Изучение механизмов реализации этого пути на протяжении десятилетий, последовавших за формулировкой центральной догмы, вскрыло гораздо более разнообразные функции РНК, чем быть только переносчиком информации от генов (ДНК) к белкам и служить матрицей для синтеза белков.
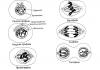
На рис. 1 представлена общая схема биосинтеза белка в клетке. РНК-посредник (messenger RNA, матричная РНК, мРНК), кодирующая белки, о которой и шла речь выше, - это лишь один из трех главных классов клеточных РНК. Основную их массу (около 80%) составляет другой класс РНК - рибосомные РНК , которые образуют структурный каркас и функциональные центры универсальных белок-синтезирующих частиц - рибосом. Именно рибосомные РНК ответственны - как в структурном, так и в функциональном отношении - за формирование ультрамикроскопических молекулярных машин, называемых рибосомами. Рибосомы воспринимают генетическую информацию в виде молекул мРНК и, будучи запрограммированы последними, делают белки в точном соответствии с данной программой.
Однако, чтобы синтезировать белки, одной только информации или программы недостаточно - нужен еще и материал, из которого их можно делать. Поток материала для синтеза белков идет в рибосомы через посредство третьего класса клеточных РНК - РНК-переносчиков (transfer RNA, транспортные РНК, тРНК). Они ковалентно связывают - акцептируют - аминокислоты, которые служат строительным материалом для беЛков, и в виде аминоацил-тРНК поступают в рибосомы. В рибосомах аминоацил-тРНК взаимодействуют с кодонами - трехнуклеотидными комбинациями - мРНК, в результате чего и происходит декодирование кодонов в процессе трансляции.
РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ
Итак, перед нами набор главных клеточных РНК, определяющих основной процесс современной живой материи - биосинтез белка. Это мРНК, рибосомные РНК и тРНК. РНК синтезируются на ДНК с помощью ферментов - РНК-полимераз, осуществляющих транскрипцию - переписывание определенных участков (линейных отрезков) двутяжевой ДНК в форму однотяжевой РНК. Участки ДНК, кодирующие клеточные белки, переписываются в виде мРНК, тогда как для синтеза многочисленных копий рибосомной РНК и тРНК имеются специальные участки клеточного генома, с которых идет интенсивное переписывание без последующей трансляции в белки.
Химическая структура РНК. Химически РНК очень похожа на ДНК. Оба вещества - это линейные полимеры нуклеотидов. Каждый мономер - нуклеотид - представляет собой фосфорилированный N-гликозид, построенный из остатка пятиуглеродного сахара - пентозы, несущего фосфатную группу на гидроксильной группе пятого углеродного атома (сложноэфирная связь) и азотистое основание при первом углеродном атоме (N-гликозидная связь). Главное химическое различие между ДНК и РНК состоит в том, что сахарный остаток мономера РНК - это рибоза, а мономера ДНК - дезоксирибоза, являющаяся производным рибозы, в котором отсутствует гидроксильная группа при втором углеродном атоме (рис. 2).
Азотистых оснований и в ДНК, и в РНК четыре вида: два пуриновых - аденин (А) и гуанин (G) -и два пиримидиновых - цитозин (С) и урацил (U) или его метилированное производное тимин (Т).
Урацил характерен для мономеров РНК, а тимин - для мономеров ДНК, и это второе различие РНК и ДНК. Мономеры - рибонуклеотиды РНК или дезоксирибонуклеотиды ДНК - образуют полимерную цепь посредством формирования фосфодиэфирных мостиков между сахарными остатками (между пятым и третьим атомами углерода пентозы). Таким образом, полимерная цепь нуклеиновой кислоты - ДНК или РНК - может быть представлена как линейный сахаро-фосфатный остов с азотистыми основаниями в качестве боковых групп.
Макромолекулярная структура РНК. Принципиальное макроструктурное различие двух типов нуклеиновых кислот состоит в том, что ДНК - это единая двойная спираль, то есть макромолекула из двух комплементарно связанных полимерных тяжей, спирально закрученных вокруг общей оси (см. [ , ]), а РНК - однотяжевой полимер. В то же время взаимодействия боковых групп - азотистых оснований - друг с другом, а также с фосфатами и гидроксилами сахаро-фосфатного остова приводят к тому, что однотяжевой полимер РНК сворачивается на себя и скручивается в компактную структуру , подобно сворачиванию полипептидной цепи белка в компактную глобулу. Таким способом уникальные нуклеотидные последовательности РНК могут формировать уникальные пространственные структуры.
Впервые специфическая пространственная структура РНК была продемонстрирована при расшифровке атомной структуры одной из тРНК в 1974 г. [ , ] (рис. 3). Сворачивание полимерной цепи тРНК, состоящей из 76 нуклеотидных мономеров, приводит к формированию очень компактного глобулярного ядра, из которого под прямым углом торчат два выступа. Они представляют собой короткие двойные спирали по типу ДНК, но организованные за счет взаимодействия участков одной и той же цепи РНК. Один из выступов является акцептором аминокислоты и участвует в синтезе полипептидной цепи белка на рибосоме, а другой предназначен для комплементарного взаимодействия с кодирующим триплетом (кодоном) мРНК в той же рибосоме. Только такая структура способна специфически взаимодействовать с белком-ферментом, навешивающим аминокислоту на тРНК, и с рибосомой в процессе трансляции, то есть специфически "узнаваться" ими.
Изучение изолированных рибосомных РНК дало следующий разительный пример формирования компактных специфических структур из еще более длинных линейных полимеров этого типа. Рибосома состоит из двух неравных частей - большой и малой рибосомных субчастиц (субъединиц). Каждая субчастица построена из одной высокополимерной РНК и целого ряда разнообразных рибосомных белков. Длина цепей рибосомных РНК весьма значительна: так, РНК малой субчастицы бактериальной рибосомы содержит более 1500 нуклеотидов, а РНК большой субчастицы - около 3000 нуклеотидов. У млекопитающих, включая человека, эти РНК еще больше - около 1900 нуклеотидов и более 5000 нуклеотидов в малой и большой субчастицах соответственно.
Было показано, что изолированные рибосомные РНК, отделенные от их белковых
партнеров и полученные в чистом виде, сами способны спонтанно сворачиваться в
компактные структуры, по своим размерам и форме похожие на рибосомные
субчастицы ].
Форма большой и малой субчастиц разная, и соответственно различается форма
большой и малой рибосомных РНК (рис. 4). Таким образом, линейные цепи
рибосомной РНК самоорганизуются в специфические пространственные структуры,
определяющие размеры, форму и, по-видимому, внутреннее устройство рибосомных
субчастиц, а следовательно, и всей рибосомы.
Минорные РНК. По мере изучения компонентов живой клетки и отдельных фракций тотальной клеточной РНК выяснялось, что тремя главными видами РНК дело не ограничивается. Оказалось, что в природе существует множество других видов РНК. Это, в первую очередь, так называемые "малые РНК", которые содержат до 300 нуклеотидов, часто с неизвестными функциями. Как правило, они ассоциированы с одним или несколькими белками и представлены в клетке в виде рибонуклеопротеидов - "малых РНП" .
Малые РНК присутствуют во всех отделах клетки, включая цитоплазму, ядро, ядрышко, ми-тохондрии. Большая часть тех малых РНП, функции которых известны, участвует в механизмах посттранскрипционной обработки главных видов РНК (RNA processing) - превращении предшественников мРНК в зрелые мРНК (сплайсинг), редактировании мРНК, биогенезе тРНК, созревании рибосомных РНК. Один из наиболее богато представленных в клетках видов малых РНП (SRP) играет ключевую роль в транспорте синтезируемых белков через клеточную мембрану. Известны виды малых РНК, выполняющих регуляторные функции в трансляции. Специальная малая РНК входит в состав важнейшего фермента, ответственного за поддержание редупликации ДНК в поколениях клеток - теломеразы. Следует сказать, что их молекулярные размеры сопоставимы с размерами клеточных глобулярных белков. Таким образом, постепенно становится ясно, что функционирование живой клетки определяется не только многообразием синтезируемых в ней белков, но и присутствием богатого набора разнообразных РНК, из которых малые РНК в значительной мере имитируют компактность и размеры белков.
Рибозимы. Вся активная жизнь построена на обмене веществ - метаболизме, и все биохимические реакции метаболизма происходят с надлежащими для обеспечения жизни скоростями только благодаря высокоэффективным специфическим катализаторам, созданным эволюцией. На протяжении многих десятилетий биохимики были уверены, что биологический катализ всегда и всюду осуществляется белками, называемыми ферментами , или энзимами. И вот в 1982-1983 гг. было показано, что в природе имеются виды РНК, которые, подобно белкам, обладают высокоспецифической каталитической активностью [ , ]. Такие РНК-катализаторы были названы рибозимами. Представлению об исключительности белков в катализе биохимических реакций пришел конец.
В настоящее время рибосому тоже принято рассматривать как рибозим. Действительно, все имеющиеся экспериментальные данные свидетельствуют о том, что синтез полипептидной цепи белка в рибосоме катализируется рибосомной РНК, а не рибосомными белками. Идентифицирован каталитический участок большой рибосомной РНК, ответственный за катализ реакции транспептидации, посредством которой осуществляется наращивание полипептидной цепи белка в процессе трансляции.
Что касается репликации вирусных ДНК, то ее механизм мало чем отличается от редупликации генетического материала - ДНК - самой клетки. В случае же вирусных РНК реализуются процессы, которые подавлены или вовсе отсутствуют в нормальных клетках, где вся РНК синтезируется только на ДНК как на матрице. При инфекции РНК-содержащими вирусами ситуация может быть двоякой. В одних случаях на вирусной РНК как на матрице синтезируется ДНК ("обратная транскрипция"), а уж на этой ДНК транскрибируются многочисленные копии вирусной РНК. В других, наиболее интересных для нас случаях на вирусной РНК синтезируется комплементарная цепь РНК, которая и служит матрицей для синтеза - репликации - новых копий вирусной РНК. Таким образом при инфекции РНК-содержащими вирусами реализуется принципиальная способность РНК детерминировать воспроизведение своей собственной структуры, как это имеет место у ДНК.
Мультифункциональность РНК. Суммирование и обзор знаний о функциях РНК позволяют говорить о необыкновенной многофункциональности этого полимера в живой природе. Можно дать следующий список основных известных функций РНК.
Генетическая репликативная функция: структурная возможность копирования (репликации) линейных последовательностей нуклеотидов через комплементарные последовательности. Функция реализуется при вирусных инфекциях и аналогична главной функции ДНК в жизнедеятельности клеточных организмов - редупликации генетического материала.
Кодирующая функция: программирование белкового синтеза линейными последовательностями нуклеотидов. Это та же функция, что и у ДНК. И в ДНК, и в РНК одни и те же триплеты нуклеотидов кодируют 20 аминокислот белков, и последовательность триплетов в цепи нуклеиновой кислоты есть программа для последовательной расстановки 20 видов аминокислот в полипептидной цепи белка.
Структурообразующая функция: формирование уникальных трехмерных структур. Компактно свернутые молекулы малых РНК принципиально подобны трехмерным структурам глобулярных белков, а более длинные молекулы РНК могут образовывать и более крупные биологические частицы или их ядра.
Функция узнавания: высокоспецифические пространственные взаимодействия с другими макромолекулами (в том числе белками и другими РНК) и с малыми лигандами. Эта функция, пожалуй, главная у белков. Она основана на способности полимера сворачиваться уникальным образом и формировать специфические трехмерные структуры. Функция узнавания является базой специфического катализа.
Каталитическая функция: специфический катализ химических реакций рибозимами. Данная функция аналогична энзиматической функции белков-ферментов.
В целом РНК предстает перед нами столь удивительным полимером, что, казалось бы, ни времени эволюции Вселенной, ни интеллекта Творца не должно было бы хватить на ее изобретение. Как можно было видеть, РНК способна выполнять функции обоих принципиально важных для жизни полимеров - ДНК и белков. Неудивительно, что перед наукой и встал вопрос: а не могло ли возникновение и самодостаточное существование мира РНК предшествовать появлению жизни в ее современной ДНК-белковой форме?
ПРОИСХОЖДЕНИЕ ЖИЗНИ
Белково-коацерватная теория Опарина. Пожалуй, первая научная, хорошо продуманная теория происхождения жизни абиогенным путем была предложена биохимиком А.И. Опариным еще в 20-х годах прошлого века [ , ]. Теория базировалась на представлении, что все начиналось с белков, и на возможности в определенных условиях спонтанного химического синтеза мономеров белков - аминокислот - и белковоподобных полимеров (полипептидов) абиогенным путем. Публикация теории стимулировала многочисленные эксперименты в ряде лабораторий мира, показавшие реальность такого синтеза в искусственных условиях. Теория быстро стала общепринятой и необыкновенно популярной.
Основным ее постулатом было то, что спонтанно возникавшие в первичном "бульоне" белковоподобные соединения объединялись" в коацерватные капли - обособленные коллоидные системы (золи), плавающие в более разбавленном водном растворе. Это давало главную предпосылку возникновения организмов - обособление некой биохимической системы от окружающей среды, ее компартментализацию. Так как некоторые белковоподобные соединения коацерватных капель могли обладать каталитической активностью, то появлялась возможность прохождения биохимических реакций синтеза внутри капель - возникало подобие ассимиляции, а значит, роста коацервата с последующим его распадом на части - размножением. Ассимилирующий, растущий и размножающийся делением коацерват рассматривался как прообраз живой клетки (рис. 5).
Все было хорошо продумано и научно обосновано в теории, кроме одной проблемы, на которую долго закрывали глаза почти все специалисты в области происхождения жизни. Если спонтанно, путем случайных безматричных синтезов в коацервате возникали единичные удачные конструкции белковых молекул (например, эффективные катализаторы, обеспечивающие преимущество данному коацервату в росте и размножении), то как они могли копироваться для распространения внутри коацервата, а тем более для передачи коацерватам-потомкам? Теория оказалась неспособной предложить решение проблемы точного воспроизведения - внутри коацервата и в поколениях - единичных, случайно появившихся эффективных белковых структур.
Мир РНК как предшественник современной жизни. Накопление знаний о генетическом коде, нуклеиновых кислотах и биосинтезе белков привело к утверждению принципиально новой идеи о ТОМ, что все начиналось вовсе не с белков, а с РНК [ - ]. Нуклеиновые кислоты являются единственным типом биологических полимеров, макромолекулярная структура которых, благодаря принципу комплементарности при синтезе новых цепей (подробнее см. ), обеспечивает возможность копирования собственной линейной последовательности мономерных звеньев, другими словами, возможность воспроизведения (репликации) полимера, его микроструктуры. Поэтому только нуклеиновые кислоты, но не белки, могут быть генетическим материалом, то есть воспроизводимыми молекулами, повторяющими свою специфическую микроструктуру в поколениях.
По ряду соображений именно РНК, а не ДНК, могла представлять собой первичный генетический материал.
Во-первых, и в химическом синтезе, и в биохимических реакциях рибонуклеотиды предшествуют дезоксирибонуклеотидам; дезоксирибонуклеотиды - продукты модификации рибонуклеотидов (см. рис. 2).
Во-вторых, в самых древних, универсальных процессах жизненного метаболизма широко представлены именно рибонуклеотиды, а не дезоксирибонуклеотиды, включая основные энергетические носители типа рибонуклеозид-полифосфатов (АТФ и т.п.).
В-третьих, репликация РНК может происходить без какого бы то ни было участия ДНК, а механизм редупликации ДНК даже в современном живом мире требует обязательного участия РНК-затравки в инициации синтеза цепи ДНК.
В-четвертых, обладая всеми теми же матричными и генетическими функциями, что и ДНК, РНК способна также к выполнению ряда функций, присущих белкам, включая катализ химических реакций. Таким образом, имеются все основания рассматривать ДНК как более позднее эволюционное приобретение - как модификацию РНК, специализированную для выполнения функции воспроизведения и хранения уникальных копий генов в составе клеточного генома без непосредственного участия в биосинтезе белков.
После того как были открыты каталитически активные РНК, идея первичности
РНК в происхождении жизни получила сильнейший толчок к развитию, и была
сформулирована концепция самодостаточного мира РНК,
предшествовавшего
современной жизни [ ,
].
Возможная схема возникновения мира РНК представлена на рис. 6.
Абиогенный синтез рибонуклеотидов и их ковалентное объединение в олигомеры и полимеры типа РНК могли происходить приблизительно в тех же условиях и в той же химической обстановке, что постулировались для образования аминокислот и полипептидов. Недавно А.Б. Четверин с сотрудниками (Институт белка РАН) экспериментально показали, что по крайней мере некоторые полирибонуклеотиды (РНК) в обычной водной среде способны к спонтанной рекомбинации, то есть обмену отрезками цепи, путем транс-эстерификации . Обмен коротких отрезков цепи на длинные, должен приводить к удлинению полирибонуклеотидов (РНК), а сама подобная рекомбинация способствовать структурному многообразию этих молекул. Среди них могли возникать и каталитически активные молекулы РНК.
Даже крайне редкое появление единичных молекул РНК, которые были способны катализировать полимеризацию рибонуклеотидов или соединение (сплайсинг) олигонуклеотидов на комплементарной цепи как на матрице [ , ], означало становление механизма репликации РНК. Репликация самих РНК-катализаторов (рибозимов) должна была повлечь за собой возникновение самореплицирующихся популяций РНК. Продуцируя свои копии, РНК размножались. Неизбежные ошибки в копировании (мутации) и рекомбинации в самореплицирующихся популяциях РНК создавали все большее разнообразие этого мира. Таким образом, предполагаемый древний мир РНК - это "самодостаточный биологический мир, в котором молекулы РНК функционировали и как генетический материал, и как энзимоподобные катализаторы" .
Возникновение биосинтеза белка. Далее на основе мира РНК должно было происходить становление механизмов биосинтеза белка, появление разнообразных белков с наследуемой структурой и свойствами, компартментализация систем биосинтеза белка и белковых наборов, возможно, в форме коацерватов и эволюция последних в клеточные структуры - живые клетки (см. рис. 6).
Проблема перехода от древнего мира РНК к современному белок-синтезирующему миру - наиболее трудная даже для чисто теоретического решения. Возможность абиогенного синтеза по-липептидов и белковоподобных веществ не помогает в решении проблемы, так как не просматривается никакого конкретного пути, как этот синтез мог бы быть сопряжен с РНК и подпасть под генетический контроль. Генетически контролируемый синтез полипептидов и белков должен был развиваться независимо от первичного абиогенного синтеза, своим путем, на базе уже существовавшего мира РНК. В литературе предложено несколько гипотез происхождения современного механизма биосинтеза белка в мире РНК, но, пожалуй, ни одна из них не может рассматриваться как детально продуманная и безупречная с точки зрения физико-химических возможностей. Представлю свою версию процесса эволюции и специализации РНК, ведущего к возникновению аппарата биосинтеза белка (рис. 7), но и она не претендует на законченность.
Предлагаемая гипотетическая схема содержит два существенных момента, кажущихся принципиальными.
Во-первых, постулируется, что абиогенно синтезируемые олигорибонуклеотиды активно рекомбинировали посредством механизма спонтанной неэнзиматической трансэстерификации , приводя к образованию удлиненных цепей РНК и давая начало их многообразию. Именно этим путем в популяции олигонуклеотидов и полинуклеотидов и могли появиться как каталитически активные виды РНК (рибозимы), так и другие виды РНК со специализированными функциями (см. рис. 7). Более того, неэнзиматическая рекомбинация олигонуклеотидов, комплементарно связывающихся с полинуклеотидной матрицей, могла обеспечить сшивание (сплайсинг) фрагментов, комплементарных этой матрице, в единую цепь. Именно таким способом, а не катализируемой полимеризацией мононуклеотидов, могло осуществляться первичные копирование (размножение) РНК. Разумеется, если появлялись рибозимы, обладавшие полимеразной активностью , то эффективность (точность, скорость и продуктивность) копирования на комплементарной. матрице должна была значительно возрастать.
Второй принципиальный момент в моей версии состоит в том, что первичный аппарат биосинтеза белка возник на базе нескольких видов специализированных РНК до появления аппарата энзиматической (полимеразной) репликации генетического материала - РНК и ДНК. Этот первичный аппарат включал каталитически активную прорибосомную РНК, обладавшую пептидил-трансферазной активностью; набор про-тРНК, специфически связывающих аминокислоты или короткие пептиды; другую прорибосомную РНК, способную взаимодействовать одновременно с каталитической прорибосомной РНК, про-мРНК и про-тРНК (см. рис. 7). Такая система уже могла синтезировать полипептидные цепи за счет катализируемой ею реакции транспептидации. Среди прочих каталитически активных белков - первичных ферментов (энзимов) - появились и белки, катализирующие полимеризацию нуклеотидов - репликазы, или НК-полимеразы.
Впрочем, возможно, что гипотеза о древнем мире РНК как предшественнике современного живого мира так и не сможет получить достаточного обоснования для преодоления основной трудности - научно правдоподобного описания механизма перехода от РНК и ее репликации к биосинтезу белка. Имеется привлекательная и детально продуманная альтернативная гипотеза А.Д. Альтштейна (Институт биологии гена РАН), в которой постулируется, что репликация генетического материала и его трансляция - синтез белка - возникали и эволюционировали одновременно и сопряженно, начиная с взаимодействия абиогенно синтезирующихся олигонуклеотидов и аминоацил-нуклеотидилатов - смешанных ангидридов аминокислот и нуклеотидов . Но это уже следующая сказка… ("И Шахразаду застигло утро, и она прекратила дозволенные речи" .)
Литература
. Watson J.D., Crick F.H.C. Molecular structure of nucleic acids // Nature. 1953. V. 171. P. 738-740.
. Watson J.D., Crick F.H.C. Genetic implications of the structure of deoxyribose nucleic acid // Nature 1953 V. 171. P. 964-967.
. Спирин А.С. Современная биология и биологическая безопасность // Вестник РАН. 1997. № 7.
. Spirin A.S. On macromolecular structure of native high-polymer ribonucleic acid in solution // Journal of Molecular Biology. 1960. V. 2. P. 436-446.
. Kirn S.H., Suddath F.L., Quigley GJ. et al. Three-dimensional tertiary structure of yeast phenylalanine transfer RNA // Science. 1974. V. 185. P. 435-40.
. Robertas J.D., Ladner J.E., Finch J.T. et al. Structure of yeast phenylalanine tRNA at 3 A resolution // Nature. 1974. V. 250. P. 546-551.
. Vasiliev V.D., Serdyuk I.N., Gudkov A.T., SPIRin A.S. Self-organization of ribosomal RNA // Sturcture, Function and Genetics of Ribosomes / Eds. Hardesty B. and Kramer G. New York: Springer-Verlag, 1986. P. 129-142.
. Baserga SJ., Steitz J.A. The diverse world of small ribo-nucleoproteins // The RNA World / Eds. Gesteland R.F. and Atkins J.F. New York: Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1993. P. 359-381.
. Kruger К., Grabowski PJ., Zaug AJ. et al. Self-splicing RNA: Autoexcision and autocyclization of the ribosomal RNA intervening sequence of Tetrahymena
. Bartel D.P., Szostak J.W. Isolation of new ribozymes from a large pool of random sequences // Science. 1993. V. 261. P. 1411-1418.
. Ekland E.H., Bartel D.P. RNA-catalysed RNA polymerization using nucleoside triphosphates // Nature. 1996 V. 382. P. 373-376.
. Orgel L.E. The origin of life - a review of facts and speculations //Trends in Biochemical Sciences. 1998. V. 23. p. 491-495.
. Альтштейн А.Д. Происхождение генетической системы: гипотеза прогенов // Молекулярная биология. 1987. Т. 21. С. 309-322.
Спирин Александр Сергеевич - академик, директор Института белка РАН, член Президиума РАН.
Тема сегодняшней лекции – синтез ДНК, РНК и белков. Синтез ДНК называется репликацией или редупликацией (удвоением), синтез РНК – транскрипцией (переписывание с ДНК), синтез белка, проводимый рибосомой на матричной РНК называется трансляцией, то есть переводим с языка нуклеотидов на язык аминокислот.
Мы постараемся дать краткий обзор всех этих процессов, в то же время останавливаясь более подробно на молекулярных деталях, для того чтобы вы получили представление, на какую глубину этот предмет изучен.
Репликация ДНК
Молекула ДНК, состоящая из двух спиралей, удваивается при делении клетки. Удвоение ДНК основано на том, что при расплетении нитей к каждой нити можно достроить комплементарную копию, таким образом получая две нити молекулы ДНК, копирующие исходную.
Здесь также указан один из параметров ДНК, это шаг спирали, на каждый полный виток приходится 10 пар оснований, заметим, что один шаг – это не между ближайшими выступами, а через один, так как у ДНК есть малая бороздка и большая. Через большую бороздку с ДНК взаимодействуют белки, которые распознают последовательность нуклеотидов. Шаг спирали равен 34 ангстрем, а диаметр двойной спирали – 20 ангстрем.
Репликацию ДНК осуществляет фермент ДНК-полимераза. Этот фермент способен наращивать ДНК только на 3΄– конце. Вы помните, что молекула ДНК антипараллельна, разные ее концы называются 3΄-конец и 5΄ - конец. При синтезе новых копий на каждой нити одна новая нить удлиняется в направлении от 5΄ к 3΄ , а другая – в направлении от 3΄ к 5-концу. Однако 5΄ конец ДНК-полимераза наращивать не может. Поэтому синтез одной нити ДНК, той, которая растет в "удобном" для фермента направлении, идет непрерывно (она называется лидирующая или ведущая нить), а синтез другой нити осуществляется короткими фрагментами (они называются фрагментами Оказаки в честь ученого, который их описал). Потом эти фрагменты сшиваются, и такая нить называется запаздывающей, в целом репликация этой нити идет медленней. Структура, которая образуется во время репликации, называется репликативной вилкой.

Если мы посмотрим в реплицирующуюся ДНК бактерии, а это можно наблюдать в электронном микроскопе, мы увидим, что у нее вначале образуется "глазок", затем он расширяется, в конце концов вся кольцевая молекула ДНК оказывается реплицированной. Процесс репликации происходит с большой точностью, но не абсолютной. Бактериальная ДНК-полимераза делает ошибки, то есть вставляет не тот нуклеотид, который был в матричной молекуле ДНК, примерно с частотой 10-6. У эукариот ферменты работают точнее, так как они более сложно устроены, уровень ошибок при репликации ДНК у человека оценивается как 10-7 – 10 -8 . Точность репликации может быть разной на разных участках геном, есть участки с повышенной частотой мутаций и есть участки более консервативные, где мутации происходят редко. И в этом следует различать два разных процесса: процесс появления мутации ДНК и процесс фиксации мутации. Ведь если мутации ведут к летальному исходу, они не проявятся в следующих поколениях, а если ошибка не смертельна, она закрепится в следующих поколениях, и мы сможем ее проявление наблюдать и изучить. Еще одной особенностью репликации ДНК является то, что ДНК-полимераза не может начать процесс синтеза сама, ей нужна «затравка». Обычно в качестве такой затравки используется фрагмент РНК. Если речь идет о геноме бактерии, то там есть специальная точка называемая origin (исток, начало) репликации, в этой точке находится последовательность, которая распознается ферментом, синтезирующим РНК. Он относится к классу РНК-полимераз, и в данном случае называется праймазой. РНК-полимеразы не нуждаются в затравках, и этот фермент синтезирует короткий фрагмент РНК – ту самую «затравку», с которой начинается синтез ДНК.
Транскрипция
Следующий процесс – транскрипция. На нем остановимся подробнее.
Транскрипция – синтез РНК на ДНК, то есть синтез комплементарной нити РНК на молекуле ДНК осуществляется ферментом РНК-полимеразой. У бактерий, например, кишечной палочки – одна РНК-полимераза, и все бактериальные ферменты очень похожи друг на друга; у высших организмов (эукариотов) – несколько ферментов, они называются РНК-полимераза I, РНК-полимераза II, РНК-полимераза III, они также имеют сходство с бактериальными ферментами, но устроены сложнее, в их состав входит больше белков. Каждый вид эукариотической РНК-полимеразы обладает своими специальными функциями, то есть транскрибирует определенный набор генов. Нить ДНК, которая служит матрицей для синтеза РНК при транскрипции называется смысловой или матричной. Вторая нить ДНК называется некодирующей (комплементарная ей РНК не кодирует белки, она "бессмысленная").
В процессе транскрипции можно выделить три этапа. Первый этап - инициация транскрипции – начало синтеза нити РНК, образуется первая связь между нуклеотидами. Затем идет наращивание нити, ее удлинение – элонгация, и, когда синтез завершен, происходит терминация, освобождение синтезированной РНК. РНК-полимераза при этом «слезает» с ДНК и готова к новому циклу транскрипции. Бактериальная РНК-полимераза изучена очень подробно. Она состоит из нескольких белковых-субъединиц: двух α-субъединиц (это маленькие субъединицы), β- и β΄-субъединиц (большие субъединицы) и ω-субъединицы. Вместе они образуют так называемый минимальный фермент, или кор-фермент. К этому кор-ферменту может присоединяться σ-субъединица. σ-субъединица необходима для начала синтеза РНК, для инициации транскрипции. После того, как инициация осуществилась, σ-субъединица отсоединяется от комплекса, и дальнейшую работу (элонгацию цепи) ведет кор-фермент. При присоединении к ДНК σ-субъединица распознает участок, на котором должна начинаться транскрипция. Он называется промотор. Промотор - это последовательность нуклеотидов, указывающих на начало синтеза РНК. Без σ-субъединицы кор-фермент промотор распознать не может. σ-субъединица вместе с кор-ферментом называется полным ферментом, или холоферментом.
Связавшись с ДНК, а именно с промотором, который распознала σ-субъединица, холофермент расплетает двунитевую спираль и начинает синтез РНК. Участок расплетенной ДНК – это точка инициации транскрипции, первый нуклеотид, к которому должен комплементарно быть присоединен рибонуклеотид. Инициируется транскрипция, σ-субъединица уходит, а кор-фермент продолжает элонгацию цепи РНК. Затем происходит терминация, кор-фермент освобождается и становится готов к новому циклу синтеза.
Как происходит элонгация транскрипции?

РНК наращивается на 3΄-конце. Присоединением каждого нуклеотида кор-фермент делает шаг по ДНК и сдвигается на один нуклеотид. Так как все в мире относительно, то можно сказать, что кор-фермент неподвижен, а сквозь него «протаскивается» ДНК. Понятно, что результат будет таким же. Но мы будем говорить о движении по молекуле ДНК. Размер белкового комплекса, составляющего кор-фермент, 150 Ǻ. Размеры РНК-полимеразы - 150×115×110Ǻ. То есть это такая наномашина. Скорость работы РНК-полимеразы – до 50 нуклеотидов в секунду. Комплекс кор-фермента с ДНК и РНК называется элонгационным комплексом. В нем находится ДНК-РНК гибрид. То есть это участок, на котором ДНК спарена с РНК, и 3΄-конец РНК открыт для дальнейшего роста. Размер этого гибрида – 9 пар оснований. Расплетенный участок ДНК занимает примерно 12 пар оснований.

РНК-полимераза связанна с ДНК перед расплетенным участком. Этот участок называется передним дуплексом ДНК, его размер – 10 пар оснований. Полимераза связана также с более длинной частью ДНК, называемой задним дуплексом ДНК. Размер матричных РНК, которые синтезируют РНК-полимеразы у бактерий, могут достигать 1000 нуклеотидов и больше. В эукариотических клетках размер синтезируемых ДНК может достигать 100000 и даже нескольких миллионов нуклеотидов. Правда, неизвестно, существуют ли они в таких размерах в клетках, или в процессе синтеза они могут успеть процессировать.
Элонгационный комплекс довольно стабилен, т.к. он должен выполнить большую работу. То есть, сам по себе он с ДНК не «свалится». Он способен перемещаться по ДНК со скоростью до 50 нуклеотидов в секунду. Этот процесс называется перемещение (или, транслокация). Взаимодействие ДНК с РНК-полимеразой (кор-ферментом) не зависит от последовательности этой ДНК, в отличие от σ-субъединицы. И кор-фермент при прохождении определенных сигналов терминации завершает синтез ДНК.

Разберем более подробно молекулярную структуру кор-фермента. Как было сказано выше, кор-фермент состоит из α- и β-субъединиц. Они соединены так, что образуют как бы «пасть» или «клешню». α-субъединицы находятся в основании этой «клешни», и выполняют структурную функцию. С ДНК и РНК они, по-видимому, не взаимодействуют. ω-субъединица – небольшой белок, который также выполняет структурную функцию. Основная часть работы приходится на долю β- и β΄-субъединиц. На рисунке β΄-субъединица показана наверху, а β-субъединица - внизу.
Внутри «пасти», которая называется главным каналом, находится активный центр фермента. Именно здесь происходит соединение нуклеотидов, образование новой связи при синтезе РНК. Главный канал в РНК-полимеразе – это то место, где во время элонгации находится ДНК. Еще в этой структуре сбоку есть так называемый вторичный канал, по которому подаются нуклеотиды для синтеза РНК.
Распределение зарядов на поверхности РНК-полимеразы обеспечивает ее функции. Распределение очень логично. Молекула нуклеиновой кислоты заряжена отрицательно. Поэтому полость главного канала, где должна удерживаться отрицательно заряженная ДНК, выложена положительными зарядами. Поверхность РНК-полимеразы выполнена отрицательно заряженными аминокислотами, чтобы ДНК к ней не прилипала.

РНК-полимераза работает как молекулярная машина, и в ней есть различные детали, каждая из которых выполняет свою функцию. Например, нависающая над "пастью" часть β΄- субъединицы удерживает передний ДНК-дуплекс. Эта часть называется "заслонкой". После связывания с ДНК заслонка опускается, проходя путь в 30 ангстрем, и зажимает ДНК так, чтобы она не могла выпасть в процессе транскрипции.
внутри "пасти" находится активный центр РНК-полимеразы, то есть то место, где непосредственно происходит комплементарное взаимодействие поступившего по боковому каналу рибонуклеоиздтрифосфата с ДНК-матрицей. Если вновь прибывший нуклеотид комплементарен матрице, то он ферментативно пришивается к свободному 3" –концу РНК. По характеру реакция образования новой связи в РНК относится к реакциям нуклеофильного замещения. В ней участвуют два иона магния. Один ион постоянно находится в активном центре, а второй ион магния поступает с нуклеотидом и после образования новой связи между рибонуклеотидами уходит, затем поступает новый нуклеотид со своим новым ионом магния.
При выходе из РНК-полимеразы ДНК-РНК гибрид должен быть расплетен. В этом участвует структура, называемая "шип".
В транслокации, то есть перемещении РНК-полимеразы по нити ДНК, участвует α-спиральная структура, снизу вверх торчащая из β-субъединицы.

Как же узнали, какая часть фермента какую роль выполняет. Молекулярные биологи поступают следующим образом. Они удаляют часть белковой последовательности и смотрят, какая функция исчезла. Было показано, что если выбросить фрагмент зажима (когда его выбрасывали, еще не знали, что он держит ДНК), то ДНК держаться не будет. Такой же результат получается, если удалить ДНК переднего дуплекса. Оставшаяся часть - РНК-ДНК гибрид и задний дуплекс – оказываются слабо связанными с РНК-полимеразой.

Известно, что магний координирует связь между фосфатами растущей молекулы ДНК и фосфатами вновь входящих нуклеотидов. При этом происходит последовательность реакций, называемых реакциями нуклеофильного замещения. Известно, каким образом меняются связи внутри этого комплекса. Новый нуклеотид приходит, будучи связанным с еще одним ионом магния. Новый нуклеотид таким образом взаимодействует с растущей цепью ДНК. В конце реакции, второй ион магния выводится из активного центра фермента.
РНК-полимераза является представителем молекулярных машин. Помимо того, что в начале синтеза ДНК опускается заслонка, меняется конформация других частей РНК-синтазы, в ней во время роста цепи РНК происходят циклические изменения, не такие сильные, как при начале синтеза цепи. В начале заслонка опускается на 30 Ǻ, а при каждом шаге фермента ДНК протягивается на один нуклеотид. В перемещении по ДНК участвует элемент РНК-полимеразы F-спираль (альфа-спиральная структуры, точащая из бета-субъединицы вверх в главный канал). F-спираль при этом изгибается, перемещается вместе с комплексом РНК-ДНК, освобождается от них и опять выпрямляется. Перемещается F-спираль за один шаг на 3,4 Ǻ. Именно такой шаг у РНК-полимеразы.
Изменение конформации различных частей РНК-полимеразы происходит за счет изменения потенциальной энергии, что связано с электростатическими и гидрофобными взаимодействиями. Можно провести следующую аналогию. Если взять поднос с горкой яблок, то после того, как мы этот поднос потрясем, яблоки будут рассыпаться ровным слоем по подносу. У них при этом изменится потенциальная энергия, связанная с действием силы тяжести. Если молекулу РНК-синтазы «потрясти» (а «трясет» ее, также как и все другие молекулы в клетке, броуновское движение), то она начнет принимать конформацию с более низкой потенциальной энергией. То есть, источником движения молекулярной машины является энергия теплового движения отдельных ее составляющих, а устройство машины таково, что это движение приводит к нужному результату. При этом молекулярная машина потребляет энергию, которая, в основном, идет на изменение состояния тех или иных связей.
Сейчас остановимся на инициации транскрипции. Как уже говорилось, инициация осуществляется с участием σ-субъединицей. Она взаимодействует со структурой ДНК, которая называется промотор. Она имеет у кишечной палочки такую структуру. За десять нуклеотидов до точки инициации находится ТАТА-бокс. Не обязательно стоит именно такая последовательность, но она является "идеальной" последовательностью для взаимодействия с σ-субъединицей, то есть такой, с которой транскрипция инициируется наиболее эффективно. Замена отдельных нуклеотидов в этой последовательности снижает эффективность инициации транскрипции. Еще примерно за 35 нуклеотидов до него находится структура, называемая «-35». Эту последовательность также распознает σ-субъединица. Эту структуру (сочетание последовательностей "–10" и "–35") назвали классическим промотором, т.к. она была описана первой. Но оказалось, что устройство промотора может быть и другим. Этот вариант включает в себя тот же ТАТА-бокс, но нет последовательности «-35», однако есть дополнительно два нуклеотида, и этого достаточно, чтобы σ-субъединица распознала промотор.
Эта структура называется расширенным промотором. σ-субъединица РНК-полимеразы садится на промотор в ДНК и разными частями белковой молекулы взаимодействует с частями промотора. Распознает его σ-субъединица через большую бороздку ДНК. После того, как σ-субъединица в составе кор-фермента связалась с промотором, ДНК на этом участке начинает плавиться (расплетаются нити ДНК). На прошлой лекции обсуждалось, что в паре А-Т связи между нуклеотидами разрываются легче, чем в паре Г-Ц, так как последняя содержит 3 водородных связи, а первая – две. Промотор содержит пары А-Т, поэтому плавится он достаточно легко. И затем начинается синтез РНК, растущая цепь РНК выталкивает σ-субъединицу и происходят еще другие изменения, которые вызывают диссоциацию σ-субъединицы от кор-фермента.

Теперь приведем пример, как изучают функции разных частей белка. Если небольшой кусочек белка отрезать и посмотреть, как изменились функции белка, то можно понять, какие были функции у отрезанного кусочка. В нашем случае сделали по-другому. Взяли две ДНК-полимеразы, одну взяли из кишечной палочки, а другую – из теплолюбивой бактерии (термофильной), которая растет при 800 С, (в лабораторных условиях их растят в колбе, которая находится в термостате в почти кипящей воде, в естественных условиях они живут в горячих источниках, есть такие, которые могут жить при 98оС), следовательно оптимум работы ее РНК-полимеразы и σ-субъединицы – 80оС, (на рисунке σ-субъединица термофильной бактерии показана красным, а кишечной палочки - желтым), а у кишечной палочки наиболее эффективная работа идет при температуре человеческого тела, (так как она живет в кишечнике). У ее σ-субъединицы всего четыре части, разрезали белок и сшивали эту σ-субъединицу с кусочком от σ-субъединицы термофильной бактерии. И потом разные кусочки от термофильной бактерии вставляли, заменяя ими разные фрагменты σ-субъединицы. Затем смотрели, активен ли полученный гибридный белок при 200 С или нет. Термофильная бактерия при такой температуре не работает, для нее это слишком холодно, а кишечная палочка активна. На рисунке видно, что при данной температуре работает только та комбинация, при которой у σ-субъединицы первая и вторая часть от кишечной палочки, а третья и четвертая от термофильной бактерии. Таким образом, делают вывод, что температуру работы σ-субъединицы определяют первая и вторая составные части.
На самом деле разрезают не белок, а ДНК, потом кусочки ДНК от разных бактерий сшивают вместе и затем вводят в бактерию, там при активизации этой части ДНК синтезируется гибридный белок. Эта технология относится к генной инженерии, она была разработана в 70-х годах.
Еще одной особенностью транскрипции является то, что кор-фермент бактериальной клетки один и тот же, а σ-субъединицы могут быть разными. У кишечной палочки всего 7 σ-субъединиц, они узнают разные промоторы. Зачем это нужно? Если клетке срочно нужно переключить синтез белков с одной группы генов на другую, она может использовать разные σ-субъединицы. Например, есть гены теплового шока, если кишечную палочку подогреть до состояния, когда жить ей станет очень тяжело, она включает аварийную систему сопротивления тепловому шоку, сопротивления тем разрушениям, которые произошли в клетке. В эту систему входит тот набор генов, который в норме работать не должен, перед этими генами свой особый промотор. И тогда другая σ-субъединица, не основная, синтезируется и активирует эти гены. То есть смена субъединицы – это смена программы работы генов. Это способ регуляции работы генов.
Трансляция
Перейдем к трансляции – синтезу белков. Она проводится рибосомами. Рибосома состоит из двух субчастиц: большой и малой.

Каждая субчастица состоит из нескольких десятков белков, каждый из которых уже изучен, известно, каким образом каждый белок уложен в субчастицу. При исследовании белков используют метод электрофореза, то есть в электрическом поле в специальном геле или специальном носителе молекулы белков разъединяются в зависимости от их заряда и молекулярного веса, то есть под действием поля они начинают двигаться и могут отодвигаться друг от друга на разное расстояние. Другим методом разделения белков является хроматография, в результате этого метода на носителе получают пятнышки, каждый из которых соответствует отдельному белку.
Белки в рибосоме держатся на каркасе, состоящем из рибосомной РНК. Формирование рибосомы начинается с того, что рибосомная РНК сворачивается и на нее в определенном порядке начинают налипать белки. На рисунке представлена рибосомная РНК. В ней самокомплементарные участки нити РНК спариваются, образуя шпильки (вторичная структура), и затем РНК сворачивается (третичная структура РНК), образуя каркас субчастиц.
Еще один вид РНК, участвующей в синтезе белка, это транспортная РНК (тРНК). Молекулы тРНК относительно небольшие (по сравнению с рибосомногй или матричной РНК). Все тРНК имеют общую вторичную структуру. За счет спаривания комплементарных участков молекулы тРНК образуется три "стебля" с петлями на концах и один "стебель", образованный 5"- и 3"-концами молекулы тРНК (иногда образуется еще дополнительная пятая петля). Изображение этой структуры похоже на крест или клеверный лист. "Голова" на этом листе представлена антикодонной петлей, здесь находится антикодо – те три нуклеотида, которые комплементарно взаимодействуют с кодоном в мРНК. Противоположный антикодонной петле стебель, образованный концами молекулы, называется акцепторным стеблем – сюда присоединяется соответствующая аминокислота. Распознают подходящие друг другу тРНК и аминокислоты специальные ферменты, называемые аминоацил-тРНК синтетазами. Для каждой аминокислоты есть своя аминоацил-тРНК синтетаза.

В рибосоме находится матричная РНК (мРНК). С кодоном (тремя нуклеотидами) мРНК комплементарно связан антикодон транспортной РНК, на которой висит остаток аминокислоты. На рисунке видна такая структура (тРНК вместе с аминокислотой, которая называется аминоцил-тРНК).

Процесс трансляции, также как и процесс транскрипции, связан с перемещением вдоль молекулы нуклеиновой кислоты, разница в том, что рибосома шагает на три нуклеотида, в то время как РНК-полимераза - на один.
Аминоцил т-РНК входит в рибосому, комплементарно связываясь с кодоном мРНК, затем происходит реакция при которой аминокислотные остатки связываются друг с другом, а т-РНК удаляется.

"Словарь" для перевода с языка нуклеотидов на язык аминокислот называется генетическим кодом. Аминокислот - 20, нуклеотидов – 4, число комбинаций из 4 по 2 = 16, а аминокислот 20, поэтому кодировка не двух, а трехбуквенная, каждая тройка называется кодоном. Каждая аминокислота кодируется тремя нуклеотидами в мРНК (которая, в свою очередь, кодируется ДНК).

В таблице на рисунке боковые столбцы кодируют левую и правую букву кодона, верхняя строка – среднюю. Например кодон AUG кодирует аминокислоту метионин. Число комбинаций из 4 по 3 = 64, то есть некоторые аминокислоты кодируются несколькими кодонами. Три кодона не кодируют никакую аминокислоту, они называются терминирующими. Когда они попадаются в мРНК, рибосома прекращает свою работу и готовая полипептидная цепь выбрасывается наружу.
Таблица генетического кода была составлена в 60-х годах. Начало положили Ниренберг и Маттеию. Они пытались производить в пробирке эксперименты на клеточных экстрактах, к которым были добавлены искусственные матрицы РНК. В то время считалось, что кодоны, состоящие из одного нуклеотида (UUU или ААА) не кодируют аминокислоты. Ниренберг и Маттеи использовали полиU-РНК (то есть состоящую только из урацилов) в качестве контроля в своих опытах, но именно в этой пробирке прошла реакция. Стало ясно, что кодон UUU кодирует аминокислоту фенилаланин. Затем была составлена таблица генетического кода.
Генетический код универсален. Он один и тот же у всех микроорганизмов. Есть небольшие отличия в генетическом коде митохондрий.
Генетическим кодом называется таблица соответствия кодонов аминокислотам. Когда журналисты пишут о том, что недавно расшифрован генетический код человека – это грубая терминологическая ошибка. Генетический код человека расшифрован тогда же, когда и всех остальных живых существ – в 60-х годах XX века. Недавно расшифрован геном человека, то есть полная последовательность нуклеотидов всех молекул ДНК.
В лекции использованы изображения РНК-полимеразы, предоставленные Андреем Кульбачинским (Институт молекулярной генетики РАН).
Белки синтезируются из двадцати аминокислот, предшественниками которых являются различные интермедиаты катаболизма, дающие их углеродные скелеты. Все аминокислоты (рис. 8.15, а ) делятся на группы в соответствии со своим биосинтетическим происхождением. Синтез аминокислот группы глутаминовой кислоты (глутаминовая кислота, глутамин, аргинин, пролин) берет начало от а-кетоглутарата, интермедиата цикла Кребса. Другой интермедиат ЦТК, оксалоацетат, дает начало цепи реакций, приводящих к образованию аспарагиновой кислоты, аспарагина, метионина, треонина, изолейцина и лизина (группа аспарагиновой кислоты). Синтезы группы ароматических аминокислот (триптофана, фенилаланина и тирозина) начинаются с конденсации ФЕП из гликолитического пути и эритрозо-4-фосфата из пентозофосфатного пути. Другие интермедиаты гликолиза, 3-ФГК и пируват, дают начало реакциям, приводящим к синтезу аминокислот группы серина (серин, глицин, цистеин) и группы пиро- виноградной кислоты (аланин, валин, лейцин) соответственно. Биосинтез гистидина сильно отличается от синтеза других аминокислот и тесно связан с путями образования пуринов. Два атома углерода пятичленного имидазольного кольца и три атома углерода боковой цепи происходят из фосфорибозилпирофосфата. Фрагмент С-N этого кольца образуется из пуринового ядра АТФ, а другой атом азота - из глутамина.
С путями биосинтеза аминокислот связано образование ряда важных азотсодержащих соединений клетки. Так, пара-оксибензойная и пара-ами- нобензойная кислоты образуются на путях биосинтеза группы ароматических аминокислот, полиамины (путресцин, спермидин, спермин) - группы глутаминовой кислоты, диаминопимелиновая и дипиколиновая кислоты - группы аспарагиновой кислоты, пантотеновая кислота - группы пирови- ноградной кислоты, а пурины и порфирины - группы серина.
Биосинтез белков (рис. 8.15, б) происходит в процессе трансляции и для своего осуществления требует присутствия не только ферментов и мономеров (аминокислот), но и матрицы (молекулы иРНК), задающей последовательность присоединения аминокислот к растущей цепи, а также специфического переносчика для активирования мономера и отбора его в соответствии с заданным кодом (тРНК). Генетический код универсален для всех живых организмов, в нем каждая тройка нуклеотидов обозначает определенную аминокислоту. Активирование аминокислоты осуществляется путем ее присоединения к «своей» тРНК с затратой энергии АТФ. Молекула тРНК имеет область, связывающую аминокислоту, петлю,
Рис. 8.15. Синтез белка:
а- обобщенная формула аминокислот; 6 - процесс трансляции распознающую тройку нуклеотидов на иРНК, и участки присоединения к рибосоме и ферменту. «Перевод» знаков генетического кода последовательности нуклеотидов иРНК в буквы цепочки аминокислот белка (трансляцию) осуществляет рибосома. Рибосома обеспечивает взаимодействие тройки нуклеотидов иРНК, тРНК, нагруженной соответствующей аминокислотой, и фермента пептидилтрансферазы, образующего пептидные связи между последней аминокислотой растущего полипептида и вновь поступившей аминокислотой. Освобожденная тРНК выбрасывается из рибосомы, а иРНК «продергивается» через рибосому, так что внутри оказывается следующая тройка нуклеотидов. Трансляция продолжается, пока рибосома не достигнет специального участка терминации на молекуле иРНК, где полипептидная цепь отделяется от рибосомы, а сама рибосома распадается на субъединицы. Обычно к одной молекуле иРНК прикрепляется большое количество рибосом, образуя полисому (рис. 8.16).
Полипептидная цепочка, растущая от N-конца (аминогруппы) к С-концу (карбоксильной группе), выходя из рибосомы, определенным образом сворачивается. За счет образования водородных связей между разными аминокислотными остатками участки полипептида приобретают вторичную структуру в виде спирали или плоскости. Эти участки складываются

Рис. 8.16.
в трехмерное образование (третичную структуру), поддерживаемое дисуль- фидными и гидрофобными взаимодействиями. Объединение нескольких таких молекул приводит к образованию четвертичной структуры. Многие белки проявляют ферментативную активность только при формировании третичной и четвертичной структуры. Трансляция прокариот может начинаться еще до завершения процесса транскрипции.
Синтез РНК
При включении гена сначала происходит локальное расплетение ДНК и синтезируется РНК-копия генетической программы. В результате сложных обработок ее специальными белками получается матричная РНК (мРНК), которая и является программой для синтеза белка. Эта РНК переносится из ядра в цитоплазму клетки, где она связывается со специальными клеточными структурами - рибосомами, настоящими молекулярными «машинами» для синтеза белка. Белок синтезируется из активированных аминокислот, присоединенных к особым транспортным РНК (т:РНК), причем каждая из аминокислот присоединена к своей специфической тРНК. Благодаря тРНК аминокислота фиксируется в каталитическом центре рибосомы, где она «пришивается» к синтезируемой белковой цепи. Из рассмотренной последовательности событий видно, что молекулы РНК играют ключевую роль в декодировании генетической информации и биосинтезе белка.
Чем больше углублялись в изучение различных биосинтетических процессов, тем чаще обнаруживали ранее неизвестные функции РНК. Оказалось, что кроме процесса транскрипции (синтеза РНК путем копирования участка ДНК) в ряде случаев, наоборот, может происходить синтез ДНК на РНК-матрицах. Этот процесс, названный обратной транскрипцией, используют в ходе своего развития многие вирусы, в том числе печально известные онкогенные вирусы и ВИЧ-1, вызывающий СПИД.
Таким образом, выяснилось, что поток генетической информации не является, как первоначально считалось, однонаправленным - от ДНК к РНК. Роль ДНК как изначально главного носителя генетической информации стала подвергаться сомнению. Тем более что многие вирусы (гриппа, клещевого энцефалита и другие) вообще не используют ДНК в качестве генетического материала, их геном построен исключительно из РНК. А далее посыпались одно за другим открытия, которые заставили совершенно по-другому взглянуть на РНК.
Все гены РНК делят на 3 группы – кодирует и-РНК, (Синтез белка – на них строится и-РНК), кодирует р-РНК, кодирует т-РНК.. У прокариот известно 7 генов, кодирующих р-РНК. Длина каждого такого гена около 5 тыс. нуклеотид. На таком гене сначала образ-ся незрелая р-РНК. В ней содержатся: несущие информацию ставки, информация о 3 видах р-РНК и о нескольких видах т-РНК. Созревание состоит в том, что вырезаются все ставки и цепи р- и т-РНК. Основная часть генов т-РНК одиночная. Часть т-РНК генов объединится в группы с генами р-РНК.
Транскрипция (от лат. transcriptio - переписывание) - процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК. Транскрипция катализируется ферментом ДНК-зависимой РНК-полимеразой.
Инициация транскрипции - сложный процесс, зависящий от последовательности ДНК вблизи транскрибируемой последовательности (а у эукариот также и от более далеких участков генома - энхансеров и сайленсеров) и от наличия или отсутствия различных белковых факторов.
Момент перехода РНК-полимеразы от инициации транскрипции к элонгации точно не
определен. Три основных биохимических события характеризуют этот переход в
случае РНК-полимеразы кишечной палочки: отделение сигма-фактора, первая
транслокация молекулы фермента вдоль матрицы и сильная стабилизация
транскрипционного комплекса, который кроме РНК-полимеразы включает растущую цепь
РНК и транскрибируемую ДНК. Эти же явления характерны и для РНК-полимераз
эукариот. Переход от инициации к элонгации сопровождается разрывом связей между
ферментом, промотором, факторами инициации транскрипции, а в ряде случаев -
переходом РНК-полимеразы в состояние компетентности в отношении элонгации
(например, фосфорилирование CTD-домена у РНК-полимеразы II). Фаза элонгации
заканчивается после освобождения растущего транскрипта и диссоциации фермента от
матрицы (терминация).
На стадии элонгации в ДНК расплетено примерно 18 пар нуклеотидов. Примерно 12
нуклеотидов матричной нити ДНК образует гибридную спираль с растущим концом цепи
РНК. По мере движения РНК-полимеразы по матрице впереди нее происходит
расплетание, а позади - восстановление двойной спирали ДНК. Одновременно
освобождается очередное звено растущей цепи РНК из комплекса с матрицей и
РНК-полимеразой. Эти перемещения должны сопровождаться относительным вращением
РНК-полимеразы и ДНК. Трудно себе представить, как это может происходить в
клетке, особенно при транскрипции хроматина. Поэтому не исключено, что для
предотвращения такого вращения двигающуюся по ДНК РНК-полимеразу сопровождают
топоизомеразы.
Элонгация осуществляется с помощью основных элонгирующих факторов, необходимых,
чтобы процесс не останавливался преждевременно.
В последнее время появились данные, показывающие, что регуляторные факторы также
могут регулировать элонгацию. РНК-полимераза в процессе элонгации делает паузы
на определенных участках гена. Особенно четко это видно при низких концентрациях
субстратов. В некоторых участках матрицы длительные задержки в продвижении
РНК-полимеразы, т. н. паузы, наблюдаются даже при оптимальных концентрациях
субстратов. Продолжительность этих пауз может контролироваться факторами
элонгации.
Синтез ДНК
Репликация ДНК – процесс самоудвоения ДНК. Происходит в S – период интерфазы. Репликация всех двуцепочечных ДНК поликонсервативна, т.е. в дочерней молекуле одна цепь родительская, а другая построена вновь. Репликация начинается в особых точках молекулы ДНК – точках инициации синтеза или точках ori. У прокариот на единственной молекуле ДНК имеется одна точка ori. У эукариот на одной молекуле ДНК (число молекул ДНК = числу хромосом) множество точек ori, расположенных на расстоянии 20000 пар нуклеотидов др. от друга. Материнская молекула ДНК начинает расходиться на 2 цепи в точке ori с образованием вилки репликации на материнской цепи (ориентированной 3"–5"). Дочерняя цепь строится из свободных дезоксинуклеотидов ядра сразу в направлении 5"-3". И это строительство совпадает с удвоением вилки репликации, эта дочерняя цепь называется лидирующей. На материнской цепи ДНК, антипараллельно матричной, дочерняя цепь запаздывающая, она строится отдельными кусками или фрагментами – указаки, т.к. направление строительства противоположно движению вилки репликации. Для начала синтеза ДНК требуется прайнер – короткая РНК – затравка длиной 5-10 рибонуклеотидов. Прайнер связывает первый свободный дезоксинуклеотид и начинает строить дочерние цепи ДНК. В лидирующей цепи прайнер один, а в запаздывающей у каждого отрезка указаки – длина этих отрезков 100-200 нуклеотидов у высших организмов, 1000-2000 у прокариот.
При синтезе макромолекул ДНК, РНК или белков один активный центр фермента не в состоянии обеспечить специфическую последовательность четырёх кодирующих единиц. Он может связывать между собой только один или несколько «строительных блоков», а нуклеиновые кислоты содержат в своём составе тысячи нуклеотидов. Поэтому природа пошла здесь по другому пути: матрицей для синтеза цепи молекулы ДНК служит другая цепь ДНК.
Транскрипция ДНК в ходе деления клеток начинается с разделения двух цепей, каждая из которых становится матрицей, синтезирующей нуклеотидную последовательность новых цепей. Хеликаза, топоизомераза и ДНК-связывающие белки расплетают ДНК, удерживают матрицу в разведённом состоянии и вращают молекулу ДНК. Правильность репликации обеспечивается точным соответствием комплементарных пар оснований. Репликация катализуется несколькими ДНК-полимеразами, а транскрипция – ферментом РНК-полимеразой. После репликации дочерние спирали закручиваются обратно уже без затрат энергии и каких-либо ферментов.
Сравнительно неплохо изучен процесс репликации и транскрипции ДНК бактерий. Их ДНК способна реплицироваться, не распрямляясь в линейную молекулу, то есть в кольцевой форме. Процесс, по-видимому, начинается на определённом участке кольца и идёт сразу в двух направлениях (в одном – непрерывно, во втором – фрагментарно с последующим «склеиванием» фрагментов). Инициация репликации находится под контролем клеточной регуляции. Скорость репликации ДНК составляет около 45 000 нуклеотидов в минуту; таким образом, родительская вилка расплетается со скоростью 4500 об/мин.
Ферменты репликации : для синтеза прайнеров нужна РНК – полимераза. для образования эфирных связей между фосфатами дезоксинуклеотидов при строительстве цепи ДНК нужна ДНК полимеразы. Для вырезания прайнеров, неправильно включённых в состав ДНК нуклеотидов, нужна ДНК – экзонуклеаза. Для сшивания фрагментов указаки в сплошную запаздывающую дочернюю цепь нужен фермент ДНГ – лигаза. Скорость синтеза ДНК у эукариот 10-100 пар нуклеотидов в секунду, а у прокариот 1500 пар (в одном месте). Репликация по типу катящегося колеса. Двухцепочечная кольцевая ДНК надрезается в точке начала катящегося кольца. Причём надрезается одна цепь из двух – матричная. К освободившемуся 3" концу этой цепи начинают пристраиваться свободные дезоксинуклеотиды. По мере удлинения дочерней цепи ДНК 5" конец из материнского кольца вытесняется. Когда 3" и 5" концы встретятся в одной точке, синтез ДНК прекращается и дочернее кольцо отделяется от материнского.
Процесс синтеза РНК по ДНК-матрице наиболее полно охарактеризован для прокариот. Хотя в клетках млекопитающих регуляция синтеза и процессинг РНК отличаются от прокариотических систем, сами процессы синтеза РНК у обоих типов организмов практически одинаковы. Вот почему описание синтеза РНК у прокариот вполне приложимо и к эукариотическим клеткам, несмотря на то что ферменты и регуляторные сигналы синтеза РНК различаются.
Последовательность рибонуклеотидов в молекуле РНК комплементарна последовательности дезоксирибонуклеотидов одной из цепей ДНК (рис. 37.8). Та из двух цепей ДНК, по которой непосредственно идет транскрипция РНК-молекул, называется кодирующей цепью. Другую цепь часто называют некодирующей цепью соответствующего гена. Важно понимать, что в двухцепочечной ДНК, содержащей много генов, кодирующая цепь каждого данного гена вовсе не обязательно представлена в рамках одной и той же цепи ДНК (рис. 39.1). Другими словами, одна цепь молекулы ДНК для одних генов является кодирующей, а для других соответственно - некодирующей. Обратите внимание, что, за исключением замещения Т на U, последовательность РНК-транскрипта идентична некодирующей цепи.
ДНК-зависимая РНК-полнмераза - это фермент, полимеризующий рибонуклеотиды в последовательность, комплементарную кодирующей цепи гена (рис. 39.2). Фермент связывается с определенным участком кодирующей цепи, называемым промотором. Затем в стартовой точке инициируется синтез
Рис. 39.2. Полимеризация рибонуклеотидов в последовательность РНК, комплементарную кодирующей цепи гена. Реакция катализируется РНК-полимеразой. (From: J. D. Watson, Molecular Biology of the Gene, 3rd. ed., Copyright 1976, 1970, 1965, by W. A. Benjamin Inc. Menlo Park,
терминирующая последовательность. Область транскрибируемой ДНК между промотором и терминатором называется единицей транскрипции. Образующаяся при этом молекула РНК, синтезируемая в направлении называется первичным транскриптом. В прокариотических организмах первичный транскрипт часто содержит РНК-копии сразу нескольких генов, а у эукариот, как правило, - лишь единичного гена. 5-Концы первичного прокариотического транскрипта и зрелой цитоплазматической РНК идентичны. Это означает, что стартовая точка транскрипции соответствует 5-нуклеотиду мРНК. У эукариот первичные транскрипты, синтезированные РНК-полимеразой II, тут же модифицируются посредством присоединения «кэпа» - -метилгуанозинтрифосфата (рис. 37.10) (он постоянно присутствует на -конце зрелых цитоплазматических мРНК). По-видимому, кэпирование необходимо как для процесса созревания первичного транскрипта, так и для последующей трансляции зрелой мРНК.
Молекула ДНК-зависимой РНК-полимеразы Е. coli состоит из четырех субъединиц - двух идентичных (а-субъединицы) и еще двух - близких по размеру, но не идентичных Р-субъединицы). Для осуществления полимеразной функции должен образоваться холофермент - комплекс так называемого корфермента, т. е. собственно РНК-полимеразы, с дополнительным белковым фактором (ст-фактор), способствующим более прочному связыванию полимеразы со специфической промоторной последовательностью ДНК. Бактерии продуцируют множество различных ст-факторов, каждый из которых функционирует в роли регулятора, модулирующего промоторную специфичность РНК-полимеразы. Появление различных ст-факторов коррелирует во времени с запуском различных «комплексных программ» экспрессии определенного набора генов в прокариотических системах, таких, как развитие бактериофагов, споруляция или ответ на тепловой шок.
Процесс синтеза РНК, изображенный на рис. 39.3, включает связывание РНК-полимеразного комплекса с ДНК-матрицей в промоторной области. Вслед за этапом инициации синтеза РНК высвобождается ст-фактор и происходит элонгация синтеза РНК в направлении антипараллельно матричной цепи ДНК. Фермент полимеризует рибонуклеотиды в определенной последовательности, отражающей структуру кодирующей цепи в соответствии с принципом комплементарности. В ходе реакции высвобождается пирофосфат. И в прокариотических, и в эукариотических организмах полимеризация РНК начинается обычно с пуринового рибонуклеотида.
По мере продвижения комплекса элонгации, содержащего РНК-полимеразу (корфермент) по кодирующей цепи, должно происходить расплетание днк. Оно необходимо для правильного образования комплементарных пар со встраиваемыми в цепь РНК рибонуклеотидами. Размер расплетенного участка ДНК постоянен в течение всего процесса транскрипции и составляет около 17 пар на молекулу полимеразы (судя по всему, он не зависит от транскрибируемой последовательности ДНК). Это позволяет предположить, что РНК-полимераза ассоциирована с дополнительным фактором, проявляющим расплетающую активность, благодаря которой и раскрывается спираль ДНК. Тот факт, что для протекания транскрипции двойная спираль ДНК должна развернуться, а цепи разойтись (по крайней мере временно), означает неизбежность некоторого нарушения структуры нуклеосом.
Сигнал терминации синтеза молекулы РНК представляет собой определенную последовательность, расположенную в рамках кодирующей цепи ДНК. Этот сигнал распознается терминирующим белком- р-фактором. После терминации синтеза данной цепи РНК корфермент отделяется от ДНК-матрицы и, связавшись с новой молекулой ст-фактора, может узнавать соответствующие про-моторные участки и приступать к синтезу новой молекулы РНК. Одну и ту же кодирующую цепь могут одновременно считывать несколько молекул РНК-полимеразы, но процесс отрегулирован таким образом, что в каждый данный момент каждая молекула транскрибирует различные участки ДНК. Электронная микрофотография синтеза РНК представлена на рис. 39.4.
В клетках млекопитающих обнаружено несколько типов ДНК-зависимых РНК-полимераз. Их свойства представлены в табл. 39.1. По-видимому, каждый из этих ферментов отвечает за транскрипцию различных наборов генов. Молекулярные массы трех важнейших классов РНК-полимераз млекопитающих варьируют в пределах 500000-600000. Их
(см. скан)
Рис. 39.3. Процесс синтеза РНК. Начало процесса показано слева вверху, где сигма-фактор, соединяясь с кор-ферментом РНК-полимеразы, образует комплекс, способный узнавать промотор и начать транскрипцию. Процесс заканчивается высвобождением РНК-полимеразы. Свободная полимераза и другие высвобожденные каталитические факторы могут принять участие в новом акте транскрипции. Символом Фер. обозначен фермент. (From J. D. Watson, Molecular Biology of the Gene, 3rd. ed., Copyright 1976, 1970, 1965 by W. A. Benjamin Inc. Mario Park, Calif.)
Таблица 39.1. Номенклатура и локализация ДНК-зависимых РНК-полимераз животных


Рис. 39.4. Электронная микрофотография множественных копий транскрибируемых генов рибосомной РНК клеток амфибий. Увеличение На фотографии видно, что при продвижении РНК-полимеразы вдоль гена длина транскрипта увеличивается. С ближним концом гена связан короткий транскрипт, а с дальним концом-гораздо более протяженный. Стрелками указано направление ) транскрипции. (Reproduced with permission from Miller О. L. Jr, Beatty B. R„ Portrait of a Gene. J. Cell Physiol. 1969. 74 :225.)
структура имеет много общего со структурой бактериальной ДНК-зависимой РНК-полимеразы. Все они имеют по две больших субъединицы и по несколько малых субъединиц. Недавние работы по клонированию и секвенированию продемонстрировали сходство аминокислотных последовательностей эукариотических и прокариотических РНК-полимераз. Функции индивидуальных субъединиц пока не выяснены. Некоторые из них могут нести регуляторные функции, осуществляя узнавание специфических последовательностей промотора и терминатора.
Один из токсинов-а-аманитин, продуцируемый грибом Amantia phaloides, является специфическим ингибитором нуклеоплазматической ДНК-зависимой РНК-полимеразы (РНК-полимеразы II), благодаря чему его удалось эффективно использовать во многих молекулярно-биологических исследованиях (см. табл. 39.1).
Сигналы транскрипции
Анализ нуклеотидной последовательности клонированных генов позволил выявить ряд областей ДНК, играющих существенную роль в процессах транскрипции. На основе изучения большого числа бактериальных генов стало возможным построение консенсусных моделей последовательностей, выполняющих функции промоторов и терминаторов транскрипции. Бактериальные промоторы состоят примерно из 40 нуклеотидных пар (4 витка двойной спирали ДНК), т.е. они достаточно малы, чтобы полностью закрываться РНК-холополимеразным комплексом Е. coli. В рамках консенсусной структуры промотора выявлены два коротких консервативных элемента. На расстоянии около 35 нуклеотидных пар в сторону 5-конца от точки начала транскрипции находится восьмичленная последовательность, изображенная на рис. 39.5. На более близком расстоянии к точке инициации транскрипции (около 10 нуклеотидов) расположен 6-членный АТ-богатый участок. Он имеет относительно низкую температуру плавления из-за отсутствия GC-nap. В связи с этим считается, что на данном участке, называемом ТАТА-последовательностью (а также Прибнов-боксом), легко происходит диссоциация цепей ДНК так, что РНК-полимераза, связанная с областью промотора, получает доступ к участку последовательности кодирующей цепи, непосредственно прилегающему к промотору со стороны 3.
Как показано на рис. 39.6, p-зависимые сигналы терминации транскрипции в клетках Е. coli также характеризуются определенной консенсусной структурой. Консервативная последовательность терминатора, состоящая примерно из 40 нуклеотидов, содержит разнесенные на некоторое расстояние инвертированные повторы и заканчивается серией АТ-пар. РНК-транскрипт, образовавшийся после прохождения транскрипционного комплекса через область инвертированных повторов, может формировать внутримолекулярную шпилечную структуру, изображенную на рис. 39.6. Транскрипция продолжается далее в вышеупомянутую АТ-область, после чего под воздействием специфического белка-терминатора, так называемого р-фактора, РНК-полимеразный комплекс останавливается и диссоциирует, высвобождая первичный РНК-транскрипт.
Транскрипционные сигналы генов млекопитающих, как и следовало ожидать, организованы более сложно. Данные, полученные с помощью генной инженерии, свидетельствуют о наличии нескольких типов сигналов, контролирующих транскрипцию. Вблизи собственно промоторной области расположены сигнальные последовательности двух типов. Одна из них указывает, где должна начаться транскрипция, а другая определяет, как часто должно происходить это событие. В гене тимидинкиназы вируса герпеса, использующего транскрипционную систему хозяина для экспрессии собственных генов, существует один уникальный сайт инициации транскрипции.

Рис. 39.5. Бактериальные промоторы содержат две высококонсервативные последовательности, отстоящие на 35 и 10 нуклеотидов со стороны -конца от точки инициации транскрипции, обозначенной

Рис. 39.6. Бактериальный сигнал терминации транскрипции, состоящий из удаленных друг от друга на некоторое расстояние инвертированных повторов и АТ-участка (сверху). После транскрипции эта область формирует в РНК-транскрипте вторичную структуру, показанную в нижней части рисунка.
Точная транскрипция с этого сайта определяется прилежащей 5-последовательностью, расположенной на участке 32-16 нуклеотидов от точки инициации. Этот участок содержит последовательность TATAAAAG, которая отчетливо гомологична функционально родственному Прибнов-боксу (ТАТААТ), расположенному обычно на расстоянии около 10 пар оснований от точки начала синтеза прокариотических мРНК. РНК-полимераза II, вероятно, связывается с ДНК в области ТАТА-бокса и начинает синтез РНК примерно через 32 нуклеотида-у остатка ти-мидина, находящегося в окружении пуриновых нуклеотидов (рис. 39.7). Таким образом, ТАТА-бокс, вероятно, является именно тем сигналом, который указывает, где должна начаться транскрипция.
Два более удаленных от сайта инициации транскрипции участка последовательности образуют один функциональный элемент, определяющий, как часто должна происходить транскрипция данного гена. Мутация в любой из этих областей, расположенных на участке от -61 до -47 и от - 105 до -80 пар оснований от точки инициации транскрипции гена тимидинкиназы, снижает частоту актов инициации в 10-20 раз. Функционирование таких промоторных элементов, контролирующих точность и частоту инициации, в сильной степени зависит от их расположения и ориентации. Замена даже единичного нуклеотида в этой области может весьма существенно сказаться на их функции. Критичным является также и расстояние до точки инициации транскрипции; при изменении -ориентации на обратную эти элементы, как правило, утрачивают регуляторную активность (рис. 39.8).
Третий класс последовательностей увеличивает или уменьшает обычный (базовый) уровень транскрипции эукариотических генов. Эти элементы в

Рис. 39.7. Транскрипция гена тимидинкиназы. ДНК-зависимая РНК-полимераза II связывается с областью, комплементарной ТАТА-боксу, и начинает транскрипцию кодирующей цепи с остатка Т, окруженного пуринами и отстоящего от ТАТА-бокса примерно на 32 нуклеотида. Первый -остаток пурина в первичном транскрипте быстро модифицируется присоединением «кэпа».

Рис. 39.8. Схема организации регуляторных блоков типичного эукариотического гена. В функциональном гене можно выделить регуляторную и структурную области, разделенные сайтом инициации транскрипции (показан стрелкой). Регуляторная область состоит из двух элементов, определяющих базовый уровень экспрессии. Проксимальный элемент, ТАТА-бокс, направляет РНК-полимеразу к сайту инициации транскрипции и, следовательно, определяет точность начала синтеза РНК. Другой регуляторный элемент (upstream) контролирует частоту, с которой происходит инициация транскрипции. Наиболее изученным регуляторным элементом этого класса является так называемый СААТ-бокс, однако в других генах могут использоваться и иные элементы. В регуляции экспрессии участвуют также энхансеры и сайленсеры - элементы, усиливающие или ослабляющие базовый уровень транскрипции, и элементы, регулирующие экспрессию определенных генов в ответ на различные сигналы (включая гормоны, тепловой шок, ионы металлов, некоторые химические препараты). Сюда же относятся и функционально подобные элементы, обусловливающие тканевую специфичность экспрессии генов. Возможно, что два последних блока регуляторных элементов функционально перекрываются (показано соединяющей линией). Зависимость функции элемента данного типа от ориентации указана стрелками. Так, проксимальный элемент обязательно должен быть в ориентации У. СААТ-бокс и аналогичные ему элементы наиболее эффективно работают в ориентации но некоторые функционируют в обеих ориентациях. Разорванные линии между квадратами указывают на то, что положения данных элементов относительно сайта инициации транскрипции строго не фиксированы. В действительности элементы регуляции экспрессии могут быть расположены также и правее (т. е. ближе к З-концу) сайта инициации транскрипции.
висимости от оказываемого ими эффекта называют «энхансерами» или «сайленсерами» соответственно. Они могут быть расположены как до (со стороны 5), так и после (со стороны 3) сайта инициации транскрипции. В отличие от промоторных последовательностей энхансеры и сайленсеры могут оказывать -эффект на расстоянии сотен и тысяч оснований от соответствующей транскрипционной единицы. Их функционирование не зависит от ориентации.
И наконец, известен еще один класс регуляторных элементов, обеспечивающих адаптивную регуляцию экспрессии некоторых генов. Представителями этого класса являются регуляторные элементы, чувствительные к гормонам (стероидам, Т3, ТРГ, сАМР, пролактину и т. д.; см. гл. 44). Сюда же включены элементы, специфически регулирующие клеточный ответ на тепловой шок, действие металлов и некоторых химических токсинов (диоксин). К этому классу относятся и определенные участки последовательности ДНК, ответственные за регуляцию тканеспецифичной экспрессии генов, например гена альбумина в печени. Некоторые из таких адаптационных структур функционируют подобно сайленсерам или энхансерам (так регуляторный элемент, чувствительный к глюкокортикоидным гормонам, действует как энхансер).
Общее свойство всех регуляторных элементов, как основных, так и дополнительных, состоит в том, что их функционирование зависит от взаимодействия определенных участков ДНК со специфическими белковыми факторами. Множество таких белковых факторов было идентифицировано (табл. 39.2). Изучению механизма влияния таких ДНК-белковых
Таблица 39.2. Некоторые регуляторные элементы, контролирующие транскрипцию, и связывающиеся с ними факторы, найденные для генов, транскрибируемых РНК-полимеразой II

взаимодействий на транскрипцию генов посвящено значительное число исследований.
Сигналы терминации транскрипции, направляемой эукариотической РНК-полимеразой II, изучены очень плохо. Однако есть основания считать, что сигналы терминации расположены на значительном расстоянии от З-конца кодирующей области эукариотических генов. Например, сигналы терминации транскрипции гена Р-глобина мыши обнаружены в нескольких местах на расстоянии 1000-2000 оснований далее сайта, по которому обычно происходит полиаденилирование транскрипта. Мало что известно о самом процессе терминации. Неизвестно, участвуют ли в терминации какие-либо специфические белковые факторы, подобные р-фактору бактерий. -Конец зрелой генерируется уже после завершения транскрипции, по-видимому, в два этапа. После того как РНК-полимераза II пройдет область, кодирующую З-конец транскрипта, первичный транскрипт расщепляется РНК-эндонуклеазой в области, отстоящей от консенсусной -последовательности AAUAAA на 15 оснований. По-видимому, в эукариотических транскриптах последовательность AAUAAA выполняет функцию сигнала разрезания РНК. Затем вновь образованный З-конец полиаденилируется в нуклеоплазме, как описано ниже.
ДНК-зависимая РНК-полимераза III, транскрибирующая гены и малых ядерных РНК ( см. гл. 37), узнает внутригенный промотор, расположенный непосредственно в рамках транскрибируемой последовательности. В случае эукариотических генов функцию внутригенного промотора выполняют два отдельных внутренних блока последовательностей. Они транскрибируются, сохраняются в зрелой в высококонсервативной области и участвуют в образовании DHU- и ТРС-петель соответственно (рис. 37.11). При изучении структуры генов тРНК in vitro было показано, что для выполнения промоторных функций расстояние между двумя блоками должно составлять 30-40 пар оснований. Транскрипция инициируется на участке между 10- и 16-м нуклеотидом перед блоком А. Что касается гена также транскрибируемого РНК-полимеразой III, то для него выявлено взаимодействие со специфическим белковым фактором транскрипции. Судя по всему, связываясь с внутригенным промотором, этот фактор взаимодействует с РНК-полимеразой III, контролируя точность расположения каталитического центра фермента в точке инициации транскрипции.