Реакция аминокислоты с серной. Аминокислоты
Аминокислоты - гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу - NH 2 и карбоксильную группу -СООН, связанные с углеводородным радикалом.Общую формулу простейших аминокислот можно записать так:
![]()
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа - NH 2 определяет основные свойства аминокислот, т. к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа -СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты - это амфотерные органические соединения. Со щелочами они реагируют как кислоты:
С сильными кислотами- как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:

Ионизация молекул аминокислот зависит от кислотного или щелочного характера среды:

Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200 °С. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала R- они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым , т. к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин. Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки -NH-СО-, например:


Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полимамидов.
К ним, кроме названного выше синтетического волокна капрона, относят, например, и энант, образующийся при поликонденсации аминоэнантовой кислоты. Для получения синтетических волокон пригодны аминокислоты с расположением амино- и карбоксильной групп на концах молекул.
Полиамиды альфа-аминокислот называются пептидами . В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды . В таких соединениях группы -NH-СО- называют пептидными.
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н + .
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H + .
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N 2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой не взаимодействуют.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах, втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
C 6 H 5 -NO 2 + 3Fe + 7HCl = +Cl- + 3FeCl 2 + 2H 2 O
Cl — + NaOH = C 6 H 5 -NH 2 + NaCl + H 2 O
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
С 6 H 5 −Cl + 2NH 3 → C 6 H 5 NH 2 + NH 4 Cl
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH 2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH 2) x R(COOH) y , где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Основные свойства аминокислот
1. Oбразование солей при взаимодействии с кислотами
NH 2 CH 2 COOH + HCl → + Cl —
2. Взаимодействие с азотистой кислотой
NH 2 -CH 2 -COOH + HNO 2 → НО-CH 2 -COOH + N 2 + H 2 O
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
3. Алкилирование
NH 2 CH 2 COOH + CH 3 I → + I —
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
И аланина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
Cl-CH 2 -COOH + 2NH 3 = NH 2 -CH 2 -COOH + NH 4 Cl
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Аминокислоты проявляют свойства и кислот, и аминов. Так, они образуют соли (за счет кислотных свойств карбоксильной группы):
NH 2 CH 2 COOH + NaOH (NH 2 CH 2 COO)Na + Н 2 О
глицин глицинат натрия
и сложные эфиры (подобно другим органическим кислотам):
NH 2 CH 2 COOH + С 2 Н 5 ОНNH 2 CH 2 C(O)OC 2 H 5 + Н 2 О
глицин этилглицинат
С более сильными кислотами аминокислоты проявляют свойства оснований и образуют соли за счет основных свойств аминогруппы:

глицин хлорид глициния
Простейший белок - полипептид, содержащий в своей структуре не менее 70 аминокислотных остатков и имеющий молекулярную массу свыше 10 000 Да (дальтон). Дальтон - единица измерения массы белков, 1 дальтон равен 1,66054·10 -27 кг (углеродная единица массы). Аналогичные соединения, состоящие из меньшего количества аминокислотных остатков, относят к пептидам. Пептидами по своей природе являются некоторые гормоны – инсулин, окситоцин, вазопрессин. Некоторые пептиды являются регуляторами иммунитета. Пептидную природу имеют некоторые антибиотики (циклоспорин А, грамицидины А, В, С и S), алкалоиды, токсины пчел и ос, змей, ядовитых грибов (фаллоидин и аманитин бледной поганки), холерный и ботулинический токсины и др.
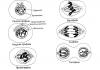
Уровни структурной организации белковых молекул .
Молекула белка имеет сложное строение. Выделяют несколько уровней структурной организации белковой молекулы – первичную, вторичную, третичную и четвертичную структуры.
Первичная структура определяется как линейная последовательность остатков протеиногенных аминокислот, связанных пептидными связями (Рис.5):

Рис.5. Первичная структура молекулы белка
Первичная структура молекулы белка генетически детерминирована для каждого конкретного белка в последовательности нуклеотидов информационной РНК. Первичная структура определяет и более высокие уровни организации белковых молекул.
Вторичная структура - конформация (т. е. расположение в пространстве) отдельных участков белковой молекулы. Вторичная структура в белках может быть представлена -спиралью, -структурой (структура складчатого листа) (Рис.6).
Рис.6. Вторичная структура белка
Вторичную структуру белка поддерживают водородные связи между пептидными группировками.
Третичная структура - конформация всей молекулы белка, т.е. укладка в пространстве всей полипептидной цепи, включая укладку боковых радикалов. Для значительного числа белков методом рентгеноструктурного анализа получены координаты всех атомов белка, за исключением координат атомов водорода. В формировании и стабилизации третичной структуры принимают участие все виды взаимодействий: гидрофобное, электростатическое (ионное), дисульфидные ковалентные связи, водородные связи. В этих взаимодействиях участвуют радикалы аминокислотных остатков. Среди связей, удерживающих третичную структуру следует отметить: а) дисульфидный мостик (- S - S -); б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой); в) солевой мостик (между карбоксильной группой и аминогруппой); г) водородные связи.
В соответствии с формой белковой молекулы, обусловленной третичной структурой, выделяют следующие группы белков
1) Глобулярные белки , которые имеют форму глобулы (сферы). К таким белкам относится, например, миоглобин, имеющий 5 α -спиральных сегментов и ни одной β – складки, иммуноглобулины, у которых нет α -спирали, основными элементами вторичной структуры являются β –складки
2) Фибриллярные белки . Эти белки имеют вытянутую нитевидную форму, они выполняют в организме структурную функцию. В первичной структуреони имеют повторяющиеся участки и формируют достаточно однотипную для всей полипептидной цепивторичную структуру. Так, белок α - кератин (основной белковый компонент ногтей, волос, кожи) построен из протяженных α - спиралей. Существуют менее распространенные элементы вторичной структуры, например - полипептидные цепи коллагена, образующие левые спирали с параметрами, резко отличающимися от параметров α -спиралей. В коллагеновых волокнах три спиральные полипептидные цепи скручены в единую правую суперспираль (Рис.7):
Рис.7 Третичная структура коллагена
Четвертичная структура белка. Под четвертичной структурой белков подразумевают способ укладки в пространстве отдельных полипептидных цепей (одинаковых или разных) с третичной структурой, приводящий к формированию единого в структурном и функциональном отношениях макромолекулярного образования (мультимера). Четвертичную структуру имеют не все белки. Примером белка, имеющего четвертичную структуру, является гемоглобин, который состоит из 4-х субъединиц. Этот белок участвует в транспорте газов в организме.
При разрыве дисульфидных и слабых типов связей в молекулах все структуры белка, кроме первичной, разрушаются (полностью или частично), при этом белок теряет свои нативные свойства (свойства белковой молекулы, присущие ей в естественном, природном (нативном) состоянии). Данный процесс называется денатурация белка . К факторам, вызывающим денатурацию белка относят высокие температуры, ультрафиолетовое облучение, концентрированные кислоты и щелочи, соли тяжелых металлов и другие.
Белки подразделяются на простые (протеины), состоящие только из аминокислот, и сложные (протеиды), содержащие, кроме аминокислот, другие небелковые вещества, например, углеводы, липиды, нуклеиновые кислоты. Небелковая часть сложного белка называется простетической группой.
Простые белки , состоящие только из остатков аминокислот, широко распространены в животном и растительном мире. В настоящее время не существует четкой классификации данных соединений.
Гистоны
Имеют сравнительно низкую молекулярную массу (12-13 тыс.), с преобладанием щелочных свойств. Локализованы в основном в ядрах клеток, растворимы в слабых кислотах, осаждаются аммиаком и спиртом. Имеют только третичную структуру. В естественных условиях прочно связаны с ДНК и входят в состав нуклеопротеидов. Основная функция - регуляция передачи генетической информации с ДНК и РНК (возможна блокировка передачи).
Протамины
Эти белки имеют самую низкую молекулярную массу (до 12 тыс.). Проявляет выраженные основные свойства. Хорошо растворимы в воде и слабых кислотах. Содержатся в половых клетках и составляют основную массу белка хроматина. Как и гистоны образуют комплекс с ДНК, придают ДНК химическую устойчивость, но в отличие от гистонов, .не выполняют регуляторной функции.
Глютелины
Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других культур, в зеленых частях растений. Не растворимы в воде, растворах солей и этанола, но хорошо растворимы в слабых растворах щелочей. Содержат все незаменимые аминокислоты, являются полноценными продуктами питания.
Проламины
Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием в этих белках пролина и неполярных аминокислот).
Протеиноиды.
К протеиноидам относятся белки опорных тканей (кость, хрящ, связки, сухожилия, ногти, волосы), для них характерно высокое содержание серы. Эти белки нерастворимы или трудно растворимы в воде, солевых и водно-спиртовых смесях..К протеиноидам относятся кератин, коллаген, фиброин.
Альбумины
Это кислые белки невысокой молекулярной массы (15-17 тыс.), растворимы в воде и слабых солевых растворах. Осаждаются нейтральными солями при 100%-м насыщении. Участвуют в поддержании осмотического давления крови, транспортируют с кровью различные вещества. Содержатся в сыворотке крови, молоке, яичном белке.
Глобулины
Молекулярная масса до 100 тыс. В воде нерастворимы, но растворимы в слабых солевых растворах и осаждаются в менее концентрированных растворах (уже при 50%-м насыщении). Содержатся в семенах растений, особенно в бобовых и масленичных; в плазме крови и в некоторых других биологических жидкостях. Выполняют функцию иммунной защиты, обеспечивают устойчивость организма к вирусным инфекционным заболеваниям.
Все -аминокислоты, кроме глицина, содержат хиральный -углеродный атом и могут встречаться в виде энантиомеров :
Было доказано, что почти все природные -аминокислоты обладают одной и той же относительной конфигурацией при -углеродном атоме. -Углеродному атому (-)-серина была условно приписана L -конфигурация, а -углеродному атому (+)-серина - D -конфигурация. При этом, если проекция -аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R - внизу, у L -аминокислоты аминогруппа будет находиться слева, а у D -аминокислоты - справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем -аминокислотам, обладающим хиральным -углеродным атомом.
Из рисунка видно, что L -аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство -аминокислот, встречающихся в природе, относится к L -ряду. Их энантиоморфы , т.е. D -аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами .
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при -углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты - амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН ), так и основной (-NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей ). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах - к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.
РЕАКЦИИ АМИНОКИСЛОТ
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (in vitro ), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет -бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.

2. образование амидов по аминогруппе. При ацилировании аминогруппы -аминокислоты образуется амид.

Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:

Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из -аминокислот, называются пептидами или полипептидами . Амидная связь в таких полимерах называется пептидной связью . Полипептиды с молекулярной массой не меньше 5000 называют белками . В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка . Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы - фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные (отношение меньше 10). К фибриллярным белкам относится коллаген , наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов .
1.Аминокислоты проявляют амфотерные свойства и кислот и аминов, а также специфические свойства, обусловленные совместным присутствием указанных групп. В водных растворах АМК существуют в виде внутренних солей (биполярных ионов). Водные растворы моноаминомонокарбоновых кислот на лакмус нейтральны, т.к. в их молекулах содержится равное число -NН 2 - и -СООН групп. Эти группы взаимодействуют между собой с образованием внутренних солей:
Такая молекула имеет в двух местах противоположные заряды: положительный NН 3 + и отрицательный на карбоксиле –СОО - . В связи с этим внутренняя соль АМК имеет название биполярного иона или Цвиттер–иона (Zwitter – гибрид).
Биполярный ион в кислой среде ведет себя как катион, так как подавляется диссоциация карбоксильной группы; в щелочной среде – как анион. Существуют значения рН специфические для каждой аминокислоты, в которой количество анионных форм в растворе равно количеству катионных форм. Значение рН при котором общий заряд молекулы АМК равен 0, называется изоэлектрической точкой АМК (pI АК).
Водные растворы моноаминодикарбоновых кислот обладают кислой реакцией среды:
HООС-СH 2 -СH-СOOH « - OOC-CH 2 -CH–COO - + H +
Изоэлектрическая точка моноаминодикарбоновых кислот находится в кислой среде и такие АМК называют кислыми.
Диаминомонокарбоновые кислоты обладают в водных растворах основными свойствами (участие воды в процессе диссоциации показывать обязательно):
NH 2 -(CH 2) 4 -CH-COOH + H 2 O « NH 3 + -(CH 2) 4 -CН–COO - + OH -
Изоэлектрическая точка диаминомонокарбоновых кислот находится в при рН>7 и такие АМК называют основными.
Являясь биполярными ионами, аминокислоты проявляют амфотерные свойства: они способны образовывать соли как с кислотами, так и с основаниями:
Взаимодействие с соляной кислотой HCl приводит к образованию соли:
R-CH-COOH + HCl ® R-CH-COOH
NH 2 NH 3 + Сl -
Взаимодействие с основанием приводит к образованию соли:
R-CH(NH 2)-COOH + NaOH ® R-CH(NH 2)-COONa + H 2 O
2. Образование комплексов с металлами – хелатный комплекс. Строение медной соли гликокола (глицина) можно изобразить следующей формулой:

Почти вся имеющаяся в организме человека медь (100 мг) связана с белками (аминокислотами) в виде этих устойчивых клешневидных соединений.
3. Подобно другим кислотам аминокислоты образуют сложные эфиры, галоген ангидриды, амиды.
4. Реакции декарбоксилирования протекают в организме при участии специальных ферментов декарбоксилаз: получающиеся при этом амины (триптамин, гистамин, серотинин) называются биогенными аминами и являются регуляторами ряда физиологических функций человеческого организма.
5. Взаимодействие с формальдегидом (альдегидами)
R-CH-COOH + H 2 C=О ® R-CH-COOH
Формальдегид связывает NН 2 – группу, -СООН группа остается свободной и может быть оттитрована щелочью. Поэтому данная реакция используется для количественного определения аминокислот (метод Сёренсена).
6. Взаимодействие с азотистой кислотой приводит к образованию гидроксикислот и выделению азота. По объему выделившегося азота N 2 определяют его количественное содержание в исследуемом объекте. Эта реакция применяется для количественного определения аминокислот (метод Ван–Слайка):
R-CH-COOH + HNO 2 ® R-CH-COOH + N 2 + H 2 O
Это один из способов дезаминирования АМК вне организма
7. Ацилирование аминокислот. Аминогруппу АМК можно ацилировать хлорангидридами и ангидридами кислот уже при комнатной температуре.
Продуктом записанной реакции является ацетил-α-аминопропионовая кислота.
Ацильные производные АМК широко используются при изучении последовательности их в белках и в синтезе пептидов (защита аминогруппы).
8.Специфические свойства, реакции, связанные с наличием и взаимным влиянием амино- и карбоксильной групп - образование пептидов. Общим свойством a-АМК является процесс поликонденсации , приводящий к образованию пептидов. В результате этой реакции формируются амидные связи по месту взаимодействию карбоксильной группы одной АМК и аминогруппы другой АМК. Другими словами, пептиды – это амиды, образующиеся в результате взаимодействия аминогрупп и карбоксилов аминокислот. Амидная связь в таких соединениях называется пептидной связью (разобрать строение пептидной группы и пептидной связи: трехцентровая р,p-сопряженная система)
В зависимости от числа аминокислотных остатков в молекуле различают ди-, три-, тетрапептиды и т.д. вплоть до полипептидов (до 100 остатков АМК). Олигопептиды содержат от 2 до 10 остатков АМК, белки - более100 остатков АМК.В общем виде полипептидную цепь можно представить схемой:
H 2 N-CH-CO-NH-CH-CO-NH-CH-CO-... -NH-CH-COOH
Где R 1 , R 2 , … R n – радикалы аминокислот.
Понятие о белках.
Наиболее важными биополимерами аминокислот являются белки – протеины. В организме человека насчитывается около 5млн. различных белков, которые входят в состав кожи, мышц, крови и других тканей. Белки (протеины) получили свое название от греческого слова «protos» - первый, важнейший. Белки выполняют ряд важнейших функций в организме: 1. Строительная функция; 2. Транспортная функция; 3. Защитная функция; 4. Каталитическая функция; 5. Гормональная функция; 6. Питательная функция.
Все природные белки образуются из мономеров аминокислот. При гидролизе белков образуется смесь АМК. Этих АМК – 20.
4. Иллюстративный материал: презентация
5. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
- Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
- Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с. : ил
- Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с. : ил.
- Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
- Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
6. Контрольные вопросы (обратная связь):
1. Что преопределяет структуру полипептидной цепи в целом?
2. К чему приводит денатурация белка?
3. Что называют изоэлектрической точкой?
4. Какие аминокислоты называются незаменимыми?
5. Каким же образом белки образуются в нашем организме?
Похожая информация.